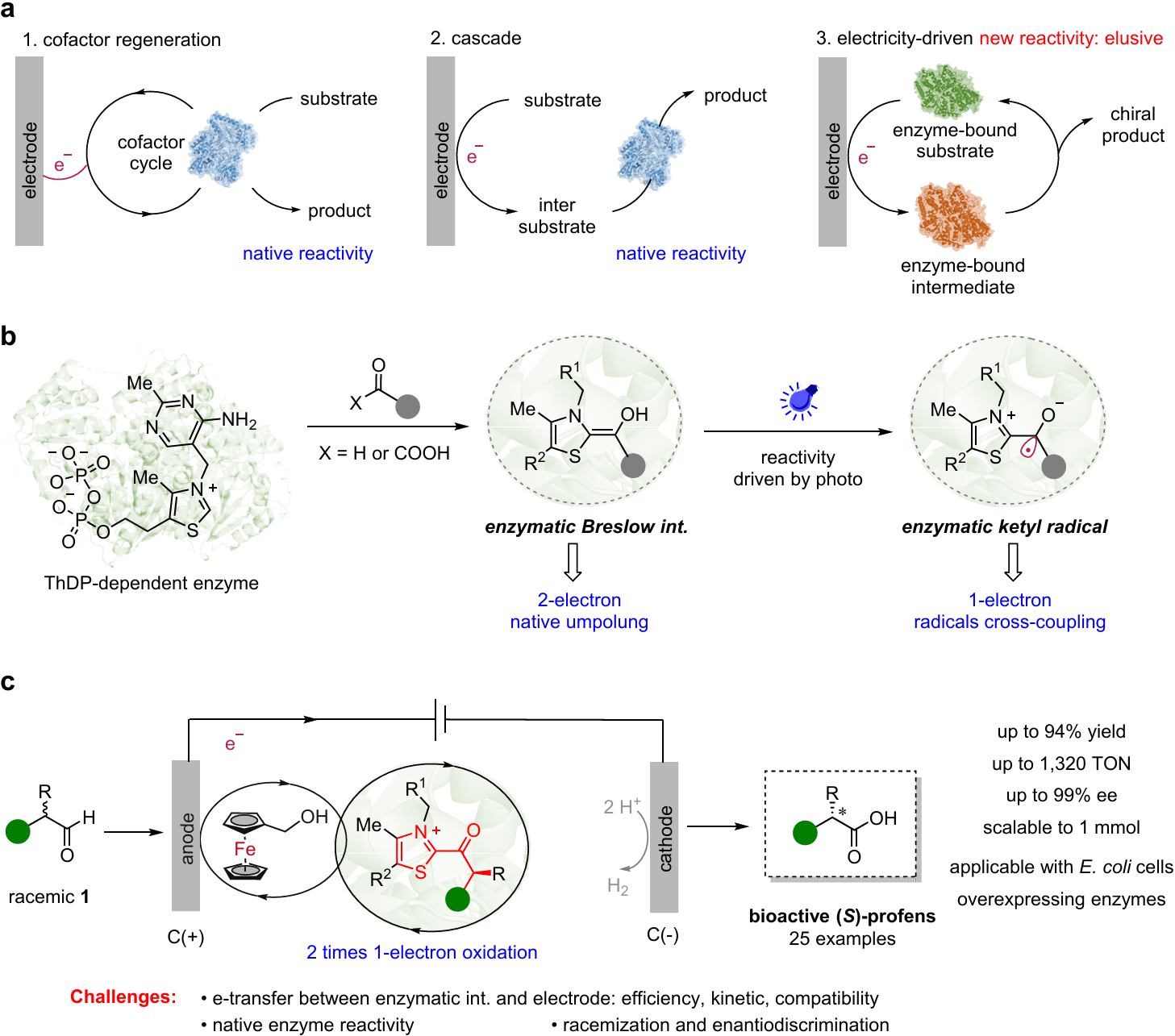
图1. 电酶催化现状及本文研究
黄小强教授团队巧妙地融合了二茂铁甲醇介导的阳极氧化和ThDP依赖酶催化的自由基过程,将连续2次单电子氧化机制引入酶中,并结合定向进化技术理性改造酶的活性位点,成功开发了一例电酶催化非天然转化(图1c),开辟了“电驱动酶催化”不对称合成新方向。
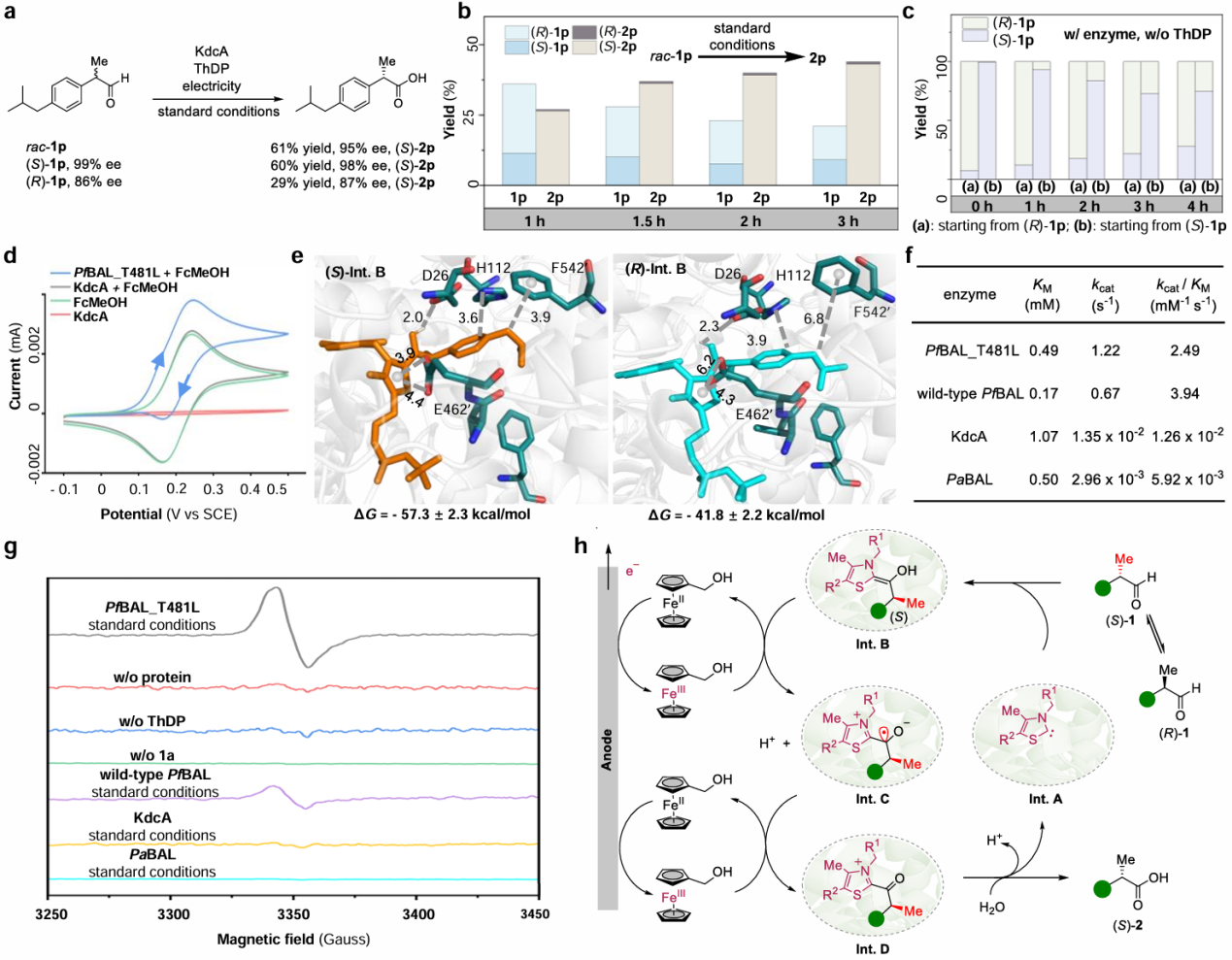
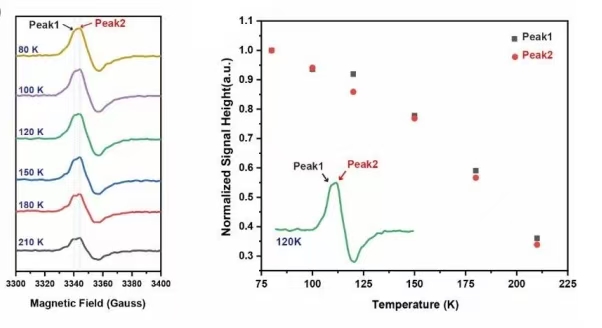
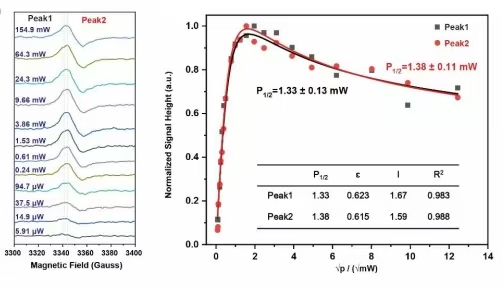
针对该电酶催化体系,团队利用EPR对其电子转移机理开展了详细研究。通过低温EPR实验检测并表征了电酶催化过程中的关键自由基中间体,并进一步通过自旋定量方法确定了该自由基中间体的浓度(图2g);通过温度依赖(temperature-dependent)EPR方法和功率饱和(power-saturation)EPR方法进一步确认了催化体系中自由基的来源(图3)。EPR实验为证实该催化体系中的自由基中间体的存在和来源提供了关键的直接实验证据。
图2. 催化机理探究
图3. 综合EPR实验(温度依赖和功率饱和实验)
通过融合电催化和酶催化,成功解锁了ThDP依赖酶的新催化功能,实现醛到手性羧酸的动态动力学氧化新转化。该成果开辟了“电驱动酶催化”不对称合成的新范式,为苯丙酸类药物的不对称生物合成提供了新途径。
南京大学化学化工学院博士研究生赵贝贝和许园园为论文的共同第一作者;黄小强教授为通讯作者。值得一提的是,这也是黄小强教授团队应用SHMFF的EPR实验测量系统和方法揭示光酶催化机制(Nature, 2024, 625, 74; Nature, 2025, 637, 1118; Nat. Catal., 2023, 6, 996)之后,利用电化学驱动解锁酶非天然新催化模式的又一项重要研究成果。

© 1996 - 强磁场科学中心 版权所有 皖ICP备05001008号-11
地址:安徽省合肥市蜀山湖路350号 邮编:230031 电话:0551-65591149 传真:0551-65591149 邮箱:chmfl@hmfl.ac.cn