近期要闻
整合素蛋白跨膜和胞内区在去污剂胶束中的液体核磁共振结构研究取得新进展
来源: 时间:2013-07-26 作者:吴芳明
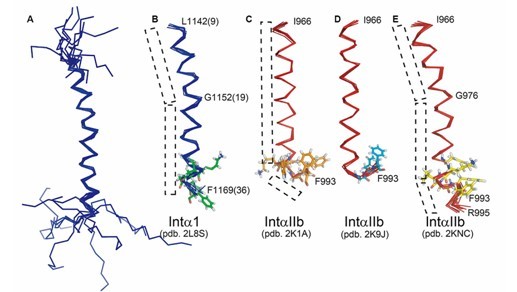
近日,中国科学院强磁场科学中心副主任田长麟教授、吴芳明博士指导研究生利用液体核磁共振方法解析了人源的整合素蛋白α1的跨膜及胞内区在去污剂中的溶液结构,并用化学位移扰动的方法分析了其与β1的跨膜及胞内区的相互作用,为进一步研究整合素α1/β1介导的双向的细胞信号传导通路提供了结构基础。
整合素蛋白是非常重要的介导细胞-细胞,细胞-胞外基质相互作用的粘着受体,在细胞信号传导和调节细胞形态、运动性和细胞周期中起着关键的作用。本研究利用液体核磁共振的方法解析了整合素蛋白α1的跨膜及胞内区在去污剂中的溶液结构,揭示了一个从跨膜区一直延伸到胞内区的长螺旋。与整合素蛋白αIIb的相应结构域的结构比较发现,α1的跨膜及胞内区具有不同的构象。进一步的核磁滴定实验显示α1与β1的跨膜及胞内区之间存在较弱的相互作用。
液体核磁共振在膜蛋白结构解析和功能分析中有着特殊的优势。近日,应用液体核磁共振方法,强磁场科学中心的石攀博士也完成了大电导钾离子通道(BK Channel)蛋白跨膜螺旋S0,S1胞内区结构域在去污剂胶束条件下的结构解析和金属离子结合分析。相关文章以“Intracellular segment between transmembrane helices S0 and S1 of BK channel alpha subunit contains two amphipathic helices connected by a flexible loop.”为题于2013年7月2日在线发表在Biochem Biophys Res Commun(http://dx.doi.org/10.1016/j.bbrc.2013.06.091)上。