中国科学院合肥物质科学研究院强磁场科学中心坐落于安徽省合肥市风景秀丽的科学岛,2008年4月30日经中国科学院批准成立,依托中国科学院合肥物质科学研究院管理(科发人教字〔2008〕133号),其前身是2005年12月20日成立的“合肥强磁场科学技术研究中心”。中心目标:发展强磁... 更多简介 +
稳态强磁场实验装置(Steady High Magnetic Field Facility,简称SHMFF)是国家发改委支持的“十一五”国家重大科技基础设施。SHMFF法人单位是中国科学院合肥物质科学研究院,共建单位是中国科学技术大学。各项任务以中国科学院强磁场科学中心为依托完成... 更多简介 +


近日,中国科学院合肥物质科学研究院强磁场科学中心王俊峰研究员课题组开发了一种膜蛋白表面等离子体共振(Surface Plasmon Resonance,SPR)传感器芯片表面固定新方法,有效克服了膜蛋白SPR分析中的关键技术瓶颈。相关成果以“A robust immobilization method for membrane protein SPR assays using SpyCatcher-SpyTag”发表在国际期刊《分析化学》(Analytical Chemistry)上。
膜蛋白约占人体蛋白质的三分之一,在细胞信号转导、物质运输等关键生命过程中发挥核心作用,也是药物研发的主要靶标。据统计,约60%的现代药物以膜蛋白为作用靶标,例如G蛋白偶联受体(GPCR)和离子通道等。因此,精确定量表征膜蛋白与蛋白质、小分子药物等各类配体间的相互作用,对于膜蛋白的功能机制解析以及创新药物开发至关重要。
SPR是一种基于光学原理的表面分析技术,能够实时监测生物分子间相互作用,并精确测定其亲和力和动力学参数。该技术具有灵敏度高、免标记等优势,被广泛应用于生命科学基础研究和药物开发等领域。SPR技术被誉为生物分子互作研究的“金标准”, 并已于2016年和2020年分别被列入美国药典和中国药典。
尽管SPR技术在可溶性蛋白研究方面已相当成熟,其在膜蛋白领域的应用仍面临挑战。主要技术瓶颈在于如何实现膜蛋白在SPR芯片表面的高效、稳定固定,并同时维持其天然构象与生物学活性。
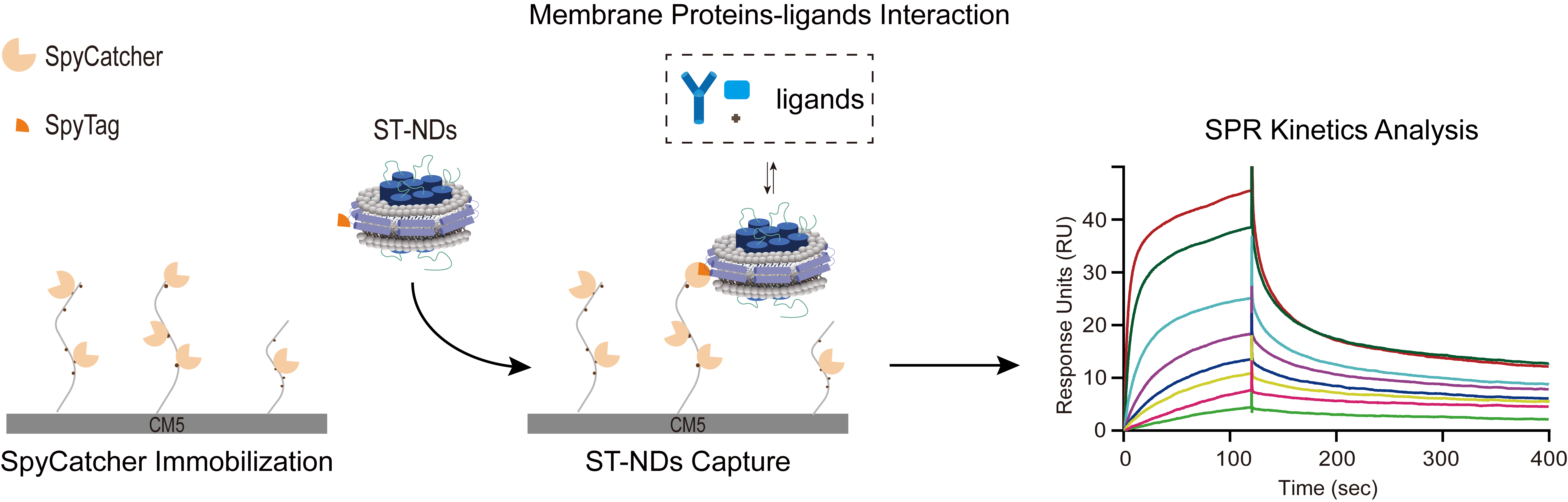
针对该瓶颈,研究团队创新性地将SpyCatcher-SpyTag共价偶联系统与膜支架蛋白(MSP)介导的脂质纳米盘技术相结合,开发出一种操作简便、高效稳定的膜蛋白芯片固定新策略。该方法通过柔性链接构建MSP-SpyTag融合蛋白,进而利用其将目标膜蛋白组装至脂质纳米盘内;所得的纳米盘携带SpyTag标签,能够与预先通过常规氨基偶联法固定于CM5芯片表面的SpyCatcher蛋白发生高效、特异的共价结合而被精准捕获,从而实现膜蛋白在近生理膜环境下的高效、稳定固定。
利用该新方法,研究团队对三种典型膜蛋白相互作用体系(蛋白-磷脂、跨膜蛋白-抗体、跨膜蛋白-小分子)进行了SPR分析。实验结果显示,该方法能够获得高质量的SPR数据,成功实现膜蛋白与配体结合的动力学及亲和力参数的精确测定。这一新方法有效解决了SPR技术在膜蛋白研究中的关键瓶颈,在膜蛋白基础研究与创新药物研发领域具有重要应用潜力。
强磁场科学中心硕士生晏丽为论文第一作者,王俊峰研究员、吴勃副研究员、赵宏鑫副研究员为共同通讯作者。该工作得到了国家重点研发计划项目、国家自然科学基金项目、安徽省重大基础研究项目以及强磁场安徽省实验室的支持。
论文链接:https://pubs.acs.org/doi/10.1021/acs.analchem.5c01671
基于SpyCatcher-SpyTag共价反应的膜蛋白芯片表面固定及SPR检测示意图

© 1996 - 强磁场科学中心 版权所有 皖ICP备05001008号-11
地址:安徽省合肥市蜀山湖路350号 邮编:230031 电话:0551-65591149 传真:0551-65591149 邮箱:chmfl@hmfl.ac.cn